Vous avez pour ambition de concevoir un dispositif médical innovant ?
Mais comment être sûr de pouvoir se lancer ?
Comment construire ce parcours vers la certification de votre dispositif médical, et donc, vers la réussite de votre projet ?
Il vous faut rester dans le wagon, malgré les montagnes russes, et ce, jusqu’à destination.
Concevoir un dispositif médical, c’est ambitieux, et surtout, c’est tout à votre honneur. Un dispositif médical est un produit de santé destiné à être utilisé à des fins de diagnostic, de prévention, de contrôle, de traitement ou d’atténuation d’une maladie ou d’une blessure.
Il existe différents types de dispositifs médicaux. Ces dispositifs ne présentent pas le même niveau de risque pour les consommateurs. Si le produit que vous souhaitez développer répond aux caractéristiques du dispositif médical, il sera indispensable de définir sa classe.
Les dispositifs médicaux sont classés en quatre catégories : I, IIa, IIb et III. La classification dépend du niveau de risque du dispositif et est définie selon l’article 51 et l’Annexe VIII du règlement européen relatif aux dispositifs médicaux 2017/745.
Toutes ces innovations sont essentielles au développement de notre système de santé actuel et participent à l’amélioration de la prise en charge des patients ainsi qu’à l’optimisation de l’organisation des soins.
Comment créer un dispositif médical ?
Pensez au fil conducteur de votre projet : l’innovation ! Vous devez imaginer un produit qui doit être utile, certes, mais votre objectif, c’est de le rendre indispensable.
Découvrons ensemble quel est le chemin à parcourir pour concevoir ce dispositif médical !
Départ imminent ! 👇
Comment bien cadrer ce lancement d’un projet innovant ?
Le lancement d’un projet innovant de dispositif médical peut être un parcours passionnant, parfois semé d’embûches. C’est pourquoi il est important de le cadrer correctement dès le début.
Le premier enjeu, c’est de créer une nouvelle promesse par le biais de votre produit.
La prise d’informations
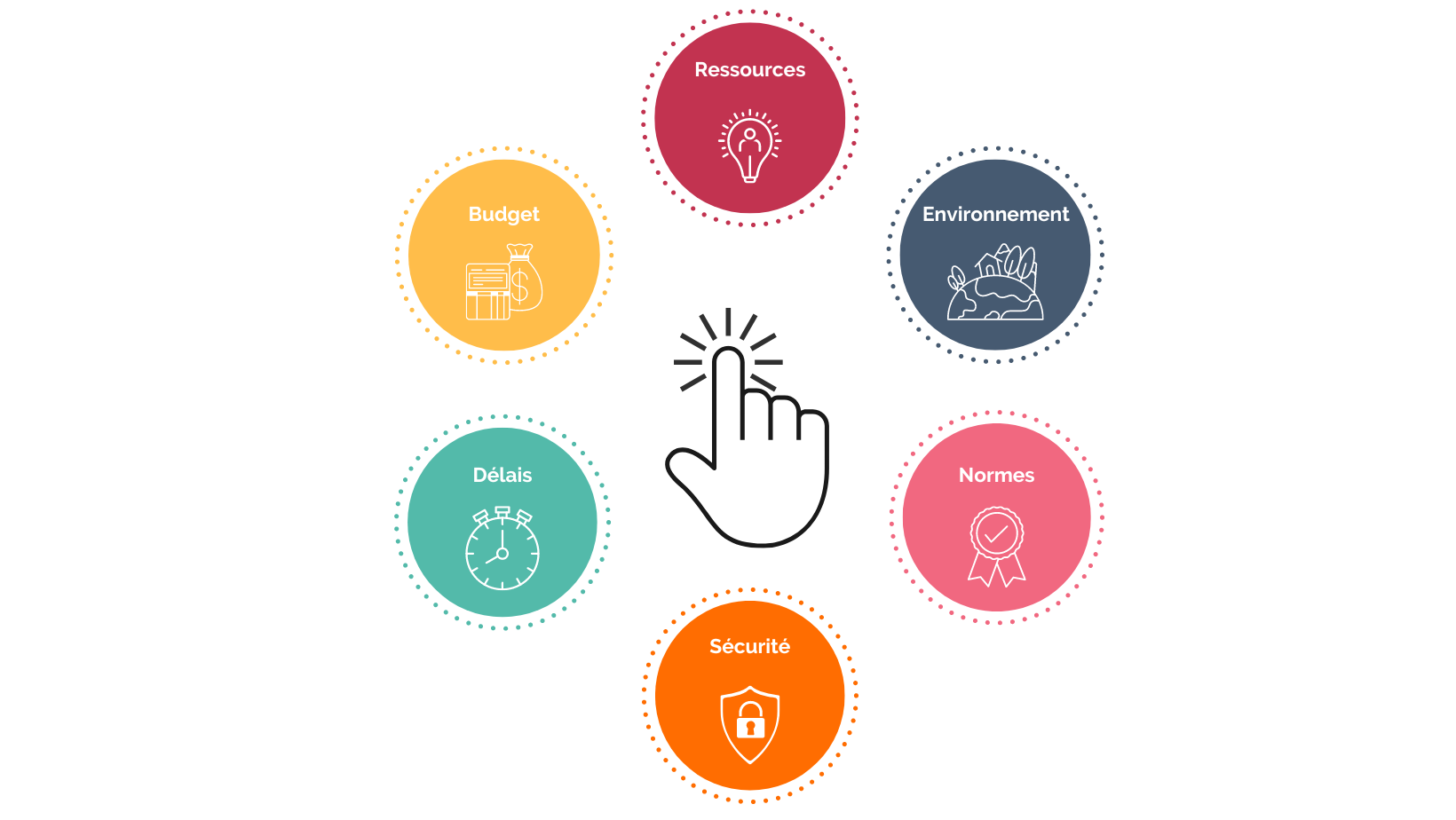
Vous devez prendre en compte l’ensemble des facteurs qui auront une influence à un moment ou un autre sur votre projet.
Un point crucial dans le développement de dispositif médical est l’environnement réglementaire et normatif.
Vous devez vous poser les bonnes questions de sorte à sécuriser votre projet. Cela passe fondamentalement par un certain nombre d’étapes :
- Avez-vous réalisé une étude approfondie sur le marché auquel se rattache votre dispositif médical ?
Une veille scientifique sera nécessaire et d’une grande aide pour vous accompagner tout au long du projet. Cette étape permet de déterminer si votre produit répondra aux besoins du marché et s’il y a une demande suffisante pour votre produit.
- Avez-vous identifié les ressources nécessaires au bon déroulement de votre projet ?
Il est important de travailler avec des personnes expérimentées en qualité et affaires réglementaires pour assurer une conformité complète à toutes les exigences. Il existe des consultants dans ce domaine tels que l’entreprise MD101. L’accompagnement pourra également être d’une grande aide pour toute la réalisation de votre documentation.
- Avez-vous cadré le contexte de développement de votre innovation assez précisément et en tenant compte des possibles itérations, ou encore, des délais pour l’obtention des certifications ?
L’élaboration d’une stratégie de développement permet de définir les normes de qualité à respecter, les exigences réglementaires, les délais de développement ainsi que les coûts associés.
Vous avez certainement déjà pris connaissance de tout ce dont vous avez besoin, mais il est important de venir souligner ces étapes clés qui vont vous soutenir dans le lancement de projet.
Comme vous vous apprêtez à investir du temps, de l’argent et de nombreuses ressources dans ce projet, vous devez le sécuriser.
Bien cadrer son projet et identifier les ressources nécessaires, c’est donc la clé d’un bon commencement. 🔑
Le marché et ses particularités
En France, le marché est contrôlé. Lorsqu’un dispositif médical ne respecte pas la législation, la réglementation ou qu’il représente un risque pour la santé, il peut subir un retrait voire un rappel du marché, ce qui peut engendrer une suspension de mise sur le marché temporaire ou définitive.
En Europe, le développement d’un dispositif médical est régi par le nouveau règlement MDR 2017/745 qui est lui-même complété par plusieurs normes (dans le cas d’électronique, logiciels ou utilisation de substances).
A l’issue du développement, si le produit est jugé conforme au règlement et aux normes/exigences applicables, il bénéficiera du marquage CE.
Le marché du dispositif médical européen suit donc des réglementations très strictes que vous aurez l’obligation de respecter pour obtenir la certification de votre dispositif médical et, in fine, pouvoir lancer la mise sur le marché.
C’est pourquoi, une maîtrise complète du marché est nécessaire. En tant que porteur de projet, il est possible que vous n’ayez pas les ressources nécessaires. Faire appel à un expert peut être d’une grande aide.
L’évolution des normes actuelles illustre bien ce besoin.
On observe des changements radicaux avec des sociétés parfois assez jeunes et qui n’ont pas toujours les ressources, une maîtrise des normes et règlements que les gens n’ont pas forcément et parfois un besoin de revoir toute une stratégie pour correspondre, de nouveau, aux exigences.
Tout ça peut engendrer des coûts supplémentaires importants et/ou une surcharge de travail. C’est là que les experts vont avoir un rôle et une valeur ajoutée importante.
Pourquoi s’entourer d’experts ?
Une équipe d’experts traite une grande quantité de sujets par an, ce qui lui permet d’avoir une vue très large. L’équipe a aussi une connaissance et une maîtrise des demandes des organismes notifiés.
Tout cela offre une vue sur :
– ce qui se fait sur le marché
– les stratégies adoptées
– les demandes des organismes notifiés
L’intervention d’un expert permet d’apporter une réponse ciblée, adaptée au besoin du client et qui facilite le passage auprès de l’organisme. C’est un accompagnement qui se fait cas par cas avec des stratégies différentes et des priorisations qui varient.
S’entourer d’une équipe qualifiée permet de s’entourer de compétences et de ressources qu’on ne possède pas toujours en tant que porteur de projet. Par exemple, si un dispositif intègre des compétences en mécanique, électronique ou autre, on peut trouver ces compétences auprès d’experts.
Aujourd’hui, le fil conducteur d’un projet de dispositif médical, c’est sa mise en conformité. Pour réussir à produire votre dispositif il vous faut un système de qualité qui englobe l’entièreté de votre projet.
Vous allez notamment devoir rédiger une documentation sur l’intégralité de votre projet afin de la présenter à un organisme normatif.
Comment savoir quels documents fournir, quelles preuves apporter, quelles étapes renseigner ? 🤔
Ces questions doivent être pensées dès le début du projet, car ne pas tout prendre en compte dès le début peut représenter un risque. Vous pourriez voir apparaître des coûts supplémentaires importants et un délai de mise sur le marché très allongé.
De nombreux experts s’occupent d’accompagner leurs clients dans la réalisation de leur stratégie globale en passant par la stratégie de tests, de vérification, de rédaction de protocoles ou encore de suivi du produit.
Ce sont ces compétences et la maîtrise de ces experts qui vous aideront à sécuriser votre projet. Que vous ayez une brique de ressources interne ou non, le point de vue d’un expert vous apportera toujours une plus-value.
Développer votre concept
Vous êtes désormais en possession de toutes les informations utiles et nécessaires à la réalisation de votre projet.
Il est essentiel de prouver la valeur de votre concept pour convaincre des potentiels futurs partenaires industriels mais aussi l’organisme de certification. Vous allez donc devoir prouver que votre solution :
- répond à un besoin sur le marché
- est réalisable d’un point de vue technique
Désormais, vous pouvez vous lancer dans la démonstration de la faisabilité technique.
Cela va déterminer si votre produit peut être développé avec les ressources dont vous disposez et si les technologies nécessaires à son développement existent ou doivent être créées.
Pour cela, vous devez réaliser le PoC (Proof of Concept).
Ce PoC est la première étape du développement. Ce prototype “classique” est une preuve qui ne nécessite pas d’être testée en conditions réelles, elle doit simplement démontrer une faisabilité.
Tant que votre dispositif médical est sous forme de PoC, vous n’avez pas de contraintes documentaires, les tests que vous réalisez n’apportent pas de vue sur le produit fini et donc vous avez une certaine liberté.
Mais le développement ne s’arrête pas là.
Vous devez rendre votre prototype compatible à l’usage que vous cherchez à démontrer.
Si vous créez un dispositif médical qui vise à être porté, utilisez des matériaux adaptés au contact avec la peau et des matériaux stables. Si vous définissez dès la réalisation du prototype vos matériaux finaux, vous pourrez anticiper la production de votre produit.
Une fois votre PoC prêt et validé, vous allez pouvoir tester réellement votre concept et venir apporter la preuve de son bénéfice à l’usage.
Vous l’aurez donc compris, ce qui va différencier le processus de développement d’un dispositif médical d’un autre produit innovant, c’est le passage obligatoire par des phases de tests et d’essais qui sont particuliers au dispositif médical.
Toutes les données récoltées durant ces phases de tests vont servir à documenter votre projet et à le faire valider auprès d’un organisme agréé pour, in fine, pouvoir le commercialiser.
Quelle importance de réaliser des essais cliniques pour son dispositif médical ?
La réalisation de tests sur un produit en cours de développement est commune à tout type de produit.
Toutefois, cette étape est particulièrement importante dans le cadre d’un dispositif médical, car elle va évaluer la sécurité et l’efficacité du dispositif en cours de développement. Elle s’accompagne aussi d’un certain nombre de tâches telles que la formalisation de dossiers spécifiques, qui seront nécessaires à la validation du dispositif médical final.
On observe clairement un fil conducteur dans le développement d’un dispositif médical c’est sa conformité. Le développement du dispositif nécessite tout un système de qualité qui englobe l’entièreté du projet.
Il faut notamment réaliser des études précliniques et cliniques pour prouver le bénéfice et enfin enregistrer toutes les preuves documentaires pour soumettre le dossier auprès de l’organisme qui donne l’autorisation de mise sur le marché.
Ainsi, vous devrez élaborer des stratégies de test, de vérification, de validation mais aussi mettre en place la rédaction de protocole, l’automatisation de tests et le suivi du produit sur le marché.
On distingue deux types de phase de développement dans le cadre du dispositif médical :
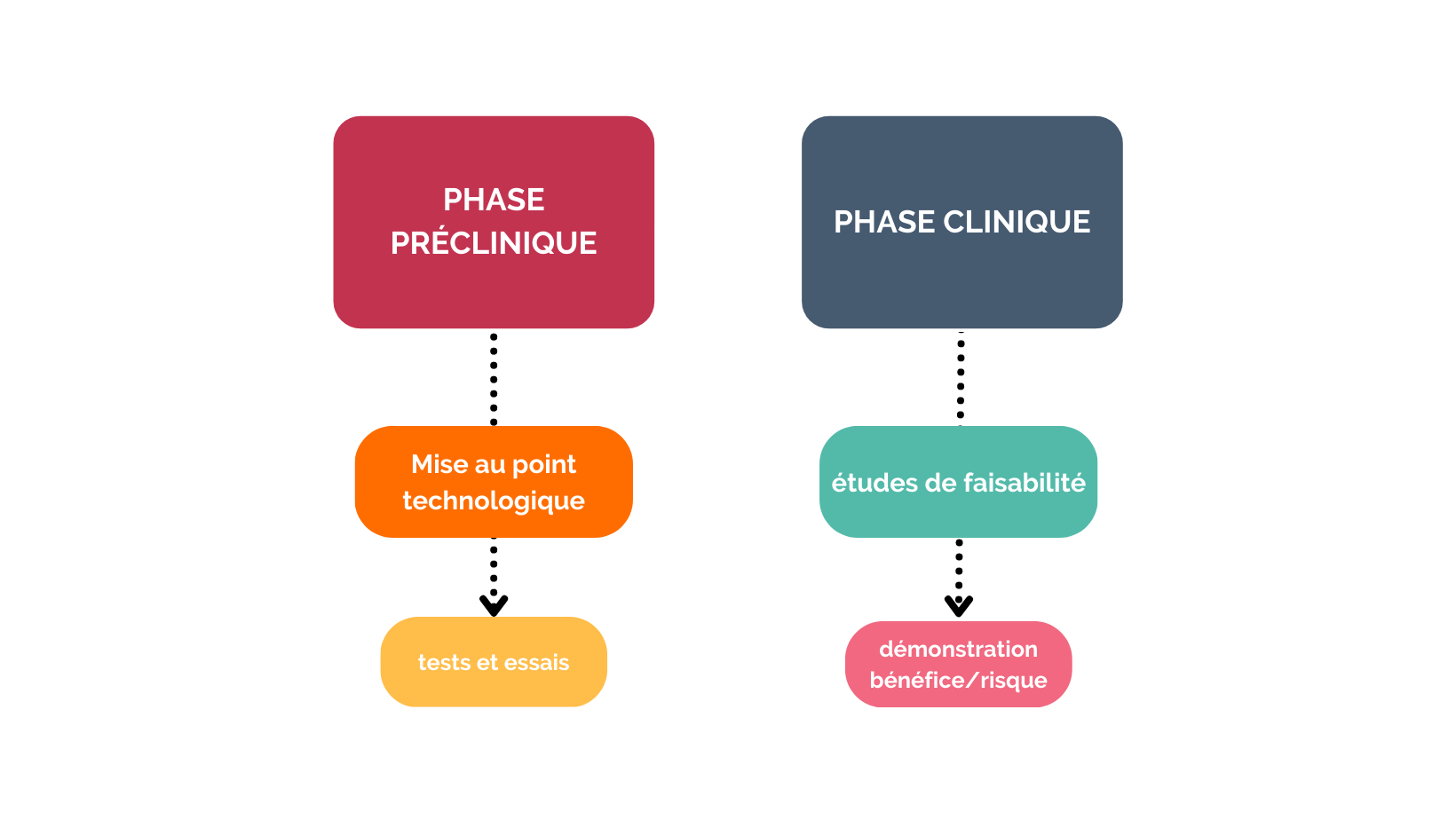
Les essais précliniques ne vont pas servir à apporter les mêmes réponses que les essais cliniques. C’est un processus de mise au point qui vise à rendre le prototype le plus fiable possible, de sorte à réaliser par la suite les essais cliniques.
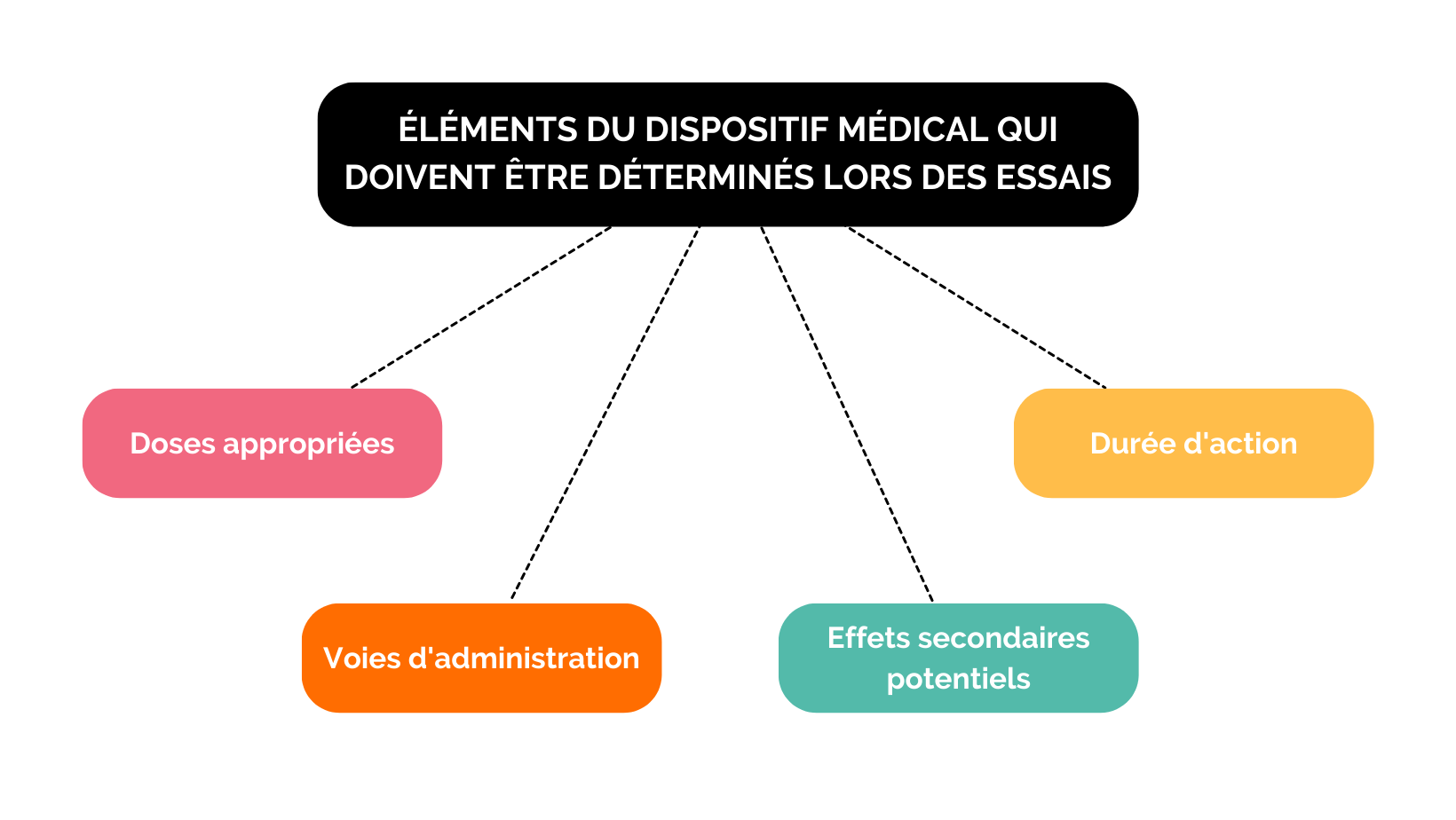
C’est lors de ces phases que vous allez démontrer l’intérêt de votre nouveau produit. Tout au long du développement de ce dispositif médical et avant de réaliser vos essais cliniques, vous devrez prendre en compte :
- Le statut du produit en fonction (par exemple) de son association ou non à un médicament
- La performance technique
- La population qui est concernée par ce medical device
- Le bénéfice clinique qui doit en résulter
- Le cycle de vie du produit
Les essais cliniques, eux, sont des tests réalisés en conditions presque réelles. On va tester le dispositif dans un cadre restreint mais on vise tout de même à démontrer les bénéfices qu’il peut et doit apporter. Pour se faire, les essais sont réalisés directement sur la “cible”.
Cette étude scientifique vise à évaluer la non-toxicité, l’efficacité et la tolérance de l’humain face à une nouvelle méthode diagnostique ou thérapeutique ou encore un traitement.
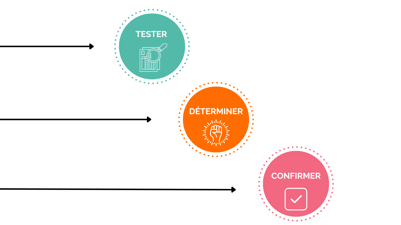
Pour conclure, ces essais permettent de tester votre produit, de déterminer les bénéfices qui peuvent en ressortir et enfin de confirmer la valeur de votre innovation.
Gardez en tête que la réalisation de ces essais est soumise à une réglementation qui constitue un cadre protecteur pour l’ensemble des potentiels utilisateurs. C’est cette réglementation qui vient garantir la sécurité. C’est pourquoi, un bon accompagnement peut considérablement vous épauler comme pour la rédaction de la documentation.
Quelle finalité pour ces essais ?
Vous l’aurez compris, les essais cliniques doivent obligatoirement être intégrés dans votre développement de dispositif médical.
Viennent ensuite s’ajouter 3 étapes finales dans la réalisation des tests :
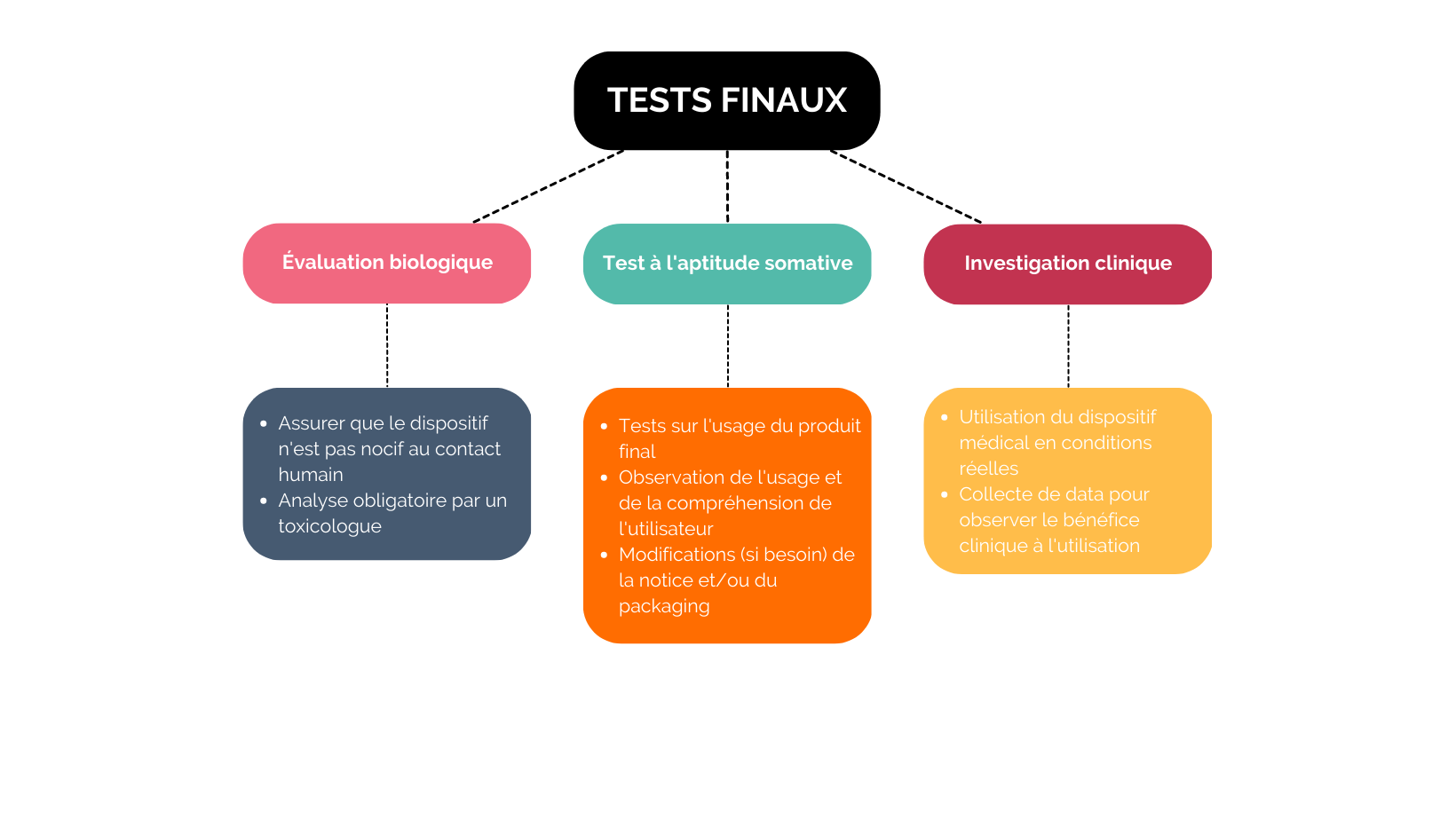
Les résultats des tous vos essais vont être examinés par les autorités réglementaires avant l’approbation du dispositif médical. Ils sont, en effet, soumis à des réglementations importantes, et c’est pourquoi l’accompagnement par un expert peut être bénéfique.
On parle d’approbation réglementaire : c’est une étape nécessaire pour commercialiser un dispositif médical.
Les régulateurs exigent des preuves solides de l’efficacité et de la sécurité d’un produit avant de l’approuver pour une utilisation sur le marché.
Les données recueillies pendant les essais sont donc utilisées pour répondre aux exigences réglementaires et pour obtenir l’approbation des autorités de réglementation.
Les enjeux de la certification pour un dispositif médical
Vous approchez de l’obstacle ultime !
On le répète depuis le début de cet article, la finalité, c’est la mise sur le marché. C’est l’approbation réglementaire de votre dispositif médical qui va vous permettre de vous lancer dans l’étape finale : sa commercialisation.
C’est une étape difficile qu’il faut avoir anticipée. L’approbation de votre dispositif médical et de sa classification n’est certes pas de votre ressort, mais c’est bel et bien à vous de tout faire pour que cette étape se passe sans encombre.
Mais comment parler d’enjeux alors que c’est un organisme qui se charge de valider ou non la mise sur le marché ?
Tout simplement car lors de votre long parcours de développement, vous avez, normalement, réalisé un dossier de documentation complet qui prouve l’intérêt de votre innovation et les bénéfices qu’elle apporte.
Un dossier incomplet peut avoir de grandes conséquences telles que :
– retour à la phase de tests et d’essais
– rédaction de la documentation
– coûts supplémentaires
– délais de développement allongés
– budget dépassé
– date de commercialisation retardée.
On peut dire que la certification n’arrive qu’à la fin du projet, mais elle est comme l’industrialisation de votre produit : à définir le plus tôt possible et à préparer tout au long de votre projet.
Vous l’aurez compris, le développement d’un dispositif médical innovant est un processus particulier.
Mais vous en êtes là, vous êtes restés dans le wagon malgré tout. 💪
En suivant les étapes clés avec du cadrage du projet, en apportant la preuve de la valeur de votre concept, en réalisant l’ensemble des tests et essais pré-cliniques et cliniques rigoureux pour obtenir la certification, les porteurs de projet peuvent considérablement améliorer les chances de succès de leur dispositif médical sur le marché.
Pour en savoir plus sur notre accompagnement auprès de porteurs de projet spécialisés dans le secteur du dispositif médical, contactez-nous !


















